Kāda ir atomu atšķirība?

Noskatīties video


Tulkošanā "atoms" nozīmē nedalāmu. To sauc par tādu, jo ilgu laiku to uzskatīja par mazāko vielas daļu. Taču zinātnes attīstība ir pierādījusi, ka tas tā nav. Tātad, noskaidrosim, kas sastāv no atoma un kādiem atšķiras dažādu elementu atomi.
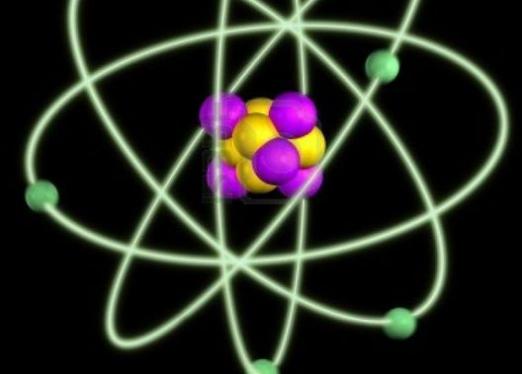
Atomu struktūra
Līdz šim zinātne zina 126 sugasķīmiskie elementi. Vispārējais to atomu struktūras plāns ir vienāds. Katrā no tām ir kodols, kas sastāv no protoniem un neitroniem, ap kuru elektroni rotē. Elektroni ir negatīvi lādētas daļiņas. Kad viņi rotē ap kodolu, veidojas elektronisks mākonis.
Protoni ir pozitīvi lādētas daļiņas. Atrodoties atpūtai, atoms satur tādu pašu protonu un elektronu skaitu, tāpēc šim ķīmiskajam elementam nav elektriskā lādiņa. Tomēr reakcijas procesā tas var dot elektronu citiem elementiem, pārvēršoties pozitīvi uzlādētā daļiņā, vai uzņemt tos, kļūstot negatīvi uzlādējamai daļiņai. Neitroniem nav nekādas maksas, taču tie ietekmē elementa masu. Attiecībā uz protoniem un neitroniem tika izgudrots vienojošais nosaukums - nukleoni.
Dažādu elementu atoms
Atomu dažādie elementi atšķiras viens no otraotru pēc protonu skaita kodolā. Elektronu skaits var mainīties, un protoni - nekad. Cik daudz protonu ir ietverti kodolā, jūs to varat noskaidrot ar elementa kārtas numuru Mendelejeva periodiskajā sistēmā. Ūdeņos (Nr. 1) atdzišanas stāvoklī 1 elektronā un 1 protonā litijā
Tā kā protonu skaits dažādiem atomiemtie atšķiras arī. Elementa masu galvenokārt veido protoni un neitroni, jo elektronu svars ir niecīgs. Bet pat viena elementa atomu svars var atšķirties, jo kodolā ir atšķirīgs neitronu skaits. Atomi, kuros neitronu skaits atšķiras no protonu skaita, sauc par izotopiem. Piemēram, dabā ir oglekļa atomi C12 (6 protoni un 6 neitroni), C13 (6 protoni un 7 neitroni) un citas šķirnes ar neitronu saturu no 2 līdz 16.
Ja jums jāzina par valency jēdzienu, lasiet par to rakstā Kas ir Valence.